کاتالیزگر ماده ای است که سرعت واکنش شیمیایی را افزایش می دهد ، اما در اثر واکنش مصرف نمی شود. از این رو می توان یک کاتالیزگر را در پایان واکنشی که برای سرعت بخشیدن از آن استفاده شده است ، بدون تغییر بازیابی کرد. کاتالیزگرها معمولاً با کاهش انرژی فعال سازی یا تغییر مکانیسم واکنش ، سرعت واکنش را افزایش می دهند. در این مقاله از کاتالیست پرشین درباره کاتالیزگر چیست؟ و چگونه بر واکنش های شیمیایی تاثیر می گذارد؟ صحبت خواهیم کرد.
تاثیر کاتالیزگر بر واکنش ها
انرژی مغز شما از راه اکسیداسیون گلوکز تامین می شود. اکسیداسیون گلوکز هم یک واکنش بسیار کند در طبیعت است. با این اوصاف انرژی مورد نیاز مغز شما باید به آهستگی تامین شود. اما سیستم های بیولوژیکی بدن شما از کاتالیزگرها افزایش سرعت واکنش اکسیداسیون استفاده می کنند تا در دماهای پایین با سرعت بیشتری انرژی مورد نیاز مغز شما را تامین کند.
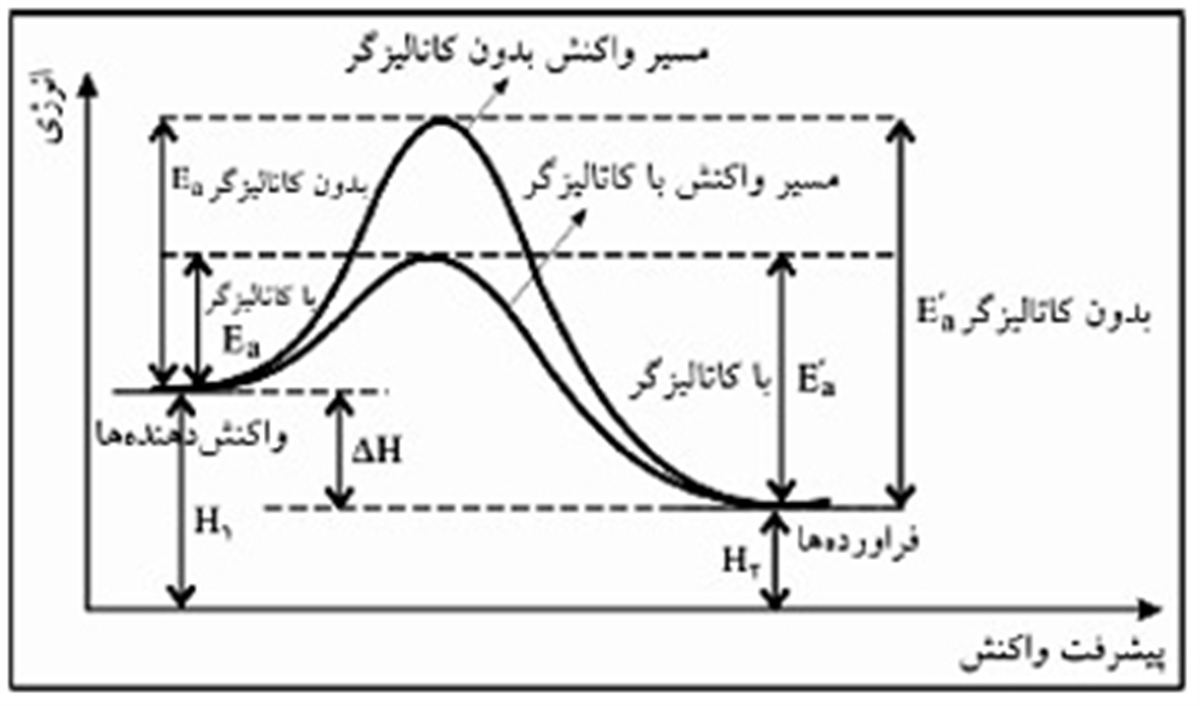
برای اینکه مواد شیمیایی واکنش نشان دهد باید پیوندهای آن ها مرتب شود، زیرا پیوندهای محصولات با پیوندهای واکنش دهنده ها متفاوت است. کندترین مرحله در بازآرایی پیوند، چیزی را ایجاد می کند که حالت گذار نامیده می شود. گونه ای شیمیایی که نه یک واکنش دهند برای واکنش مواد شیمیایی ، پیوندهای آنها باید مرتب شود ، زیرا پیوندهای محصولات با پیوندهای واکنش دهنده ها متفاوت است. کندترین مرحله در بازآرایی پیوند ، چیزی را ایجاد می کند که حالت گذار نامیده می شود. گونه ای شیمیایی که نه یک واکنش دهنده است و نه یک محصول ، بلکه واسطه ای بین این دو است.
برای تشکیل حالت گذار انرژی لازم است. این انرژی را انرژی فعال سازی یا E a می نامند.

واکنش دهنده های کاتالیزگر
انرژی فعال سازی را می توان مانعی در برابر واکنش شیمیایی تصور کرد ، مانعی که باید از آن عبور کرد. اگر سد زیاد باشد ، تعداد کمی از مولکول ها انرژی جنبشی کافی برای برخورد ، ایجاد حالت گذار و عبور از سد را دارند. واکنش دهنده های با انرژی کمتر از E a نمی توانند از حالت گذار عبور کنند تا واکنش نشان دهند و تبدیل به محصول شوند.
در این وضعیت یک کاتالیزگر با ایجاد یک مسیر متفاوت ، با E a پایین تر ، برای واکنش کار می کند. کاتالیزگرها سد انرژی را پایین می آورند. مسیر متفاوت اجازه می دهد تا بازآرایی پیوندهای مورد نیاز برای تبدیل واکنش دهنده ها به محصولات با سهولت بیشتر و با ورودی انرژی کمتر ، انجام شود. در هر بازه زمانی مشخص ، وجود یک کاتالیزگر به تعداد بیشتری از گونه های واکنش دهنده اجازه می دهد تا انرژی کافی برای عبور از حالت گذار و تبدیل شدن به محصولات را بدست بیاورند.
انواع کاتالیزگر
کاتالیزور به دو نوع کاتالیزور مرغوب و نامرغوب تقسیم میشود:
کاتالیزور مرغوب: کاتالیزور مرغوب به کاتالیزوری گفته میشود که فقط اجازه تشکیل یک نوع محصول را بدهد.
نامرغوب: اگر در حضور کاتالیزور محصولات متفاوتی امکان تشکیل داشته باشند کاتالیزور نامرغوب تلقی میشود.
کاتالیزگرهای ناهمگن: این کاتالیزگرها ترکیبات جامدی هستندکه به مخلوط وانش مایع یا گاز اضافه می شوند. دلیل اینکه این کاتالیزگرها قادر به سرعت بخشیدن به واکنش هستند، مربوط به تئوری برخورد است. طبق طئوری برخورد، مولکول های واکنش دهنده باید با جهت مناسبی به یکدیگر برخورد کنند.
کاتالیزگرهای همگن: کاتالیزگر همگن دسته ای از کاتالیزورها است که در آن کاتالیزگر با مواد واکنش دهنده تشکیل یک فاز پیوسته می دهد. نمونه هایی از کاتالیزگرهای همگن شامل تجزیه اسید ، تجزیه ساختار فلزی و تجزیه آنزیمی هستند. غالباً ، تجزیه همگن شامل کاتالیزگر فاز آبی در محلول آبی واکنش دهنده ها است. در چنین مواردی ، اسیدها و بازها اغلب کاتالیزگرهای بسیار موثری هستند زیرا می توانند با تأثیر بر قطب بندی پیوند ، واکنشها را تسریع کنند.
اهمیت کاتالیزگر
از نظر تئوری مطالعه کاتالیزگرها مورد توجه است زیرا آنچه در مورد ماهیت اصلی واکنش های شیمیایی وجود دارد را مشخص می کند. از نقطه نظر عملی نیز ، مطالعه کاتالیزگرها از اهمیت ویژه ای برخوردار است ، زیرا بسیاری از فرآیندهای صنعتی برای موفقیت به کاتالیزگرها وابسته هستند. اساساً ، فعل و انفعالات عجیب و غریبی که باعث حیات ما می شوند بدون وجود آنزیم ها که همان نقش کاتالیزگرها را در بدن ما بازی می کنند غیر قابل پیشرف هستند.
تاثیر کاتالیزگر بر تعادل واکنش
از آنجا که یک واکنش شیمیایی معکوس ممکن است با برگرداندن مراحل تشکیل مکانیسم واکنش رو به عقب پیش برود ، کاتالیزگر برای یک واکنش معین واکنش را در هر دو جهت به همان اندازه تسریع می کند. بنابراین ، یک کاتالیزگر روی موقعیت تعادل یک واکنش شیمیایی تأثیر نمی گذارد. این تنها بر میزان دستیابی به تعادل واکنش تأثیر می گذارد. استثنائات ظاهری از این تعمیم آن واکنش هایی است که در آن یکی از محصولات همچنین کاتالیزگر واکنش است. به این واکنش ها اتوکاتالیستی می گویند
آنزیم ها کاتالیزگر واکنش بیوشیمیایی
در بدن ما و سایر موجودات زنده آنزیم ها برای تسریع واکنش های بیوشیمیایی حضور دارند. آنزیم نوعی کاتالیزگر است. زندگی موجودات زنده بدون آنزیم ها غیرممکن است زیرا آنزیم ها موجب می شوند واکنش ها با سرعت مناسب انجام گیرند. آنزیم ها می توانند به واکنش دهنده ها وصل شوند و یک مسیر واکنش جایگزین ایجاد می کنند.
پرشین کاتالیست در خدمت شما مشتریان عزیز برای تعمیر کاتالیزور می باشد.
برای تعمیر گیربکس به تعمیرگاه اتوروور مراجعه کنید.

دیدگاهتان را بنویسید